Volver a ¨Psicofarmacología – Psicodinámica IV (Indice General)¨
Psicofarmacología en niños y adolescentes
15-2. Tratamiento psicofarmacológico
Existen en la actualidad psicofármacos que pueden aliviar al niño y a sus padres de las cargas sintomáticas de numerosos trastornos infantiles.
1) Principios generales
Antes de iniciar un tratamiento psicofarmacológico se debe realizar una evaluación cuidadosa del niño y su familia, tomando en cuenta los aspectos psiquiátrico, clínico, social, cognoscitivo y educativo.
La historia clínica exhaustiva deberá incluir antecedentes personales y familiares, especialmente referidos a antecedentes de: trastornos renales, cardiológicos, neurológicos, antecedentes convulsivos, trastornos tiroideos, dietas o medicamentos que interfieran en la regulación del sodio, etc.
Según qué psicofármaco se considere administrar, se deberán solicitar distintos análisis clínicos (hemograma, hepatograma, ionograma, función tiroidea, T3, T4, TSH, función renal, orina de 24 hs, clearance de creatinina, ECG, EEG, TAC, RMN, SPECT), ritmos de sueño y alimentación, peso, altura, frecuencia cardíaca y presión arterial.
La utilización de escalas de evaluación puede facilitar la ponderación de la severidad de los síntomas y de la respuesta al tratamiento.
Es preferible realizar diagnósticos de tipo multiaxial, basados en los manuales del DSM-IV o el ICD-10, teniendo en cuenta los diagnósticos diferenciales y los factores médicos y neurológicos que acompañen al cuadro clínico.
En los casos con problemas de aprendizaje, se deberá efectuar una evaluación psicopedagógica, para incluir un plan educativo acorde con las necesidades y posibilidades del niño. Cuando coexistan varios trastornos, como por ejemplo un trastorno por déficit de atención con hiperactividad con tics (síndrome de Tourette), se dará prioridad a la intervención psicofarmacológica más adecuada: la que actúe sobre los aspectos que más perturban al niño en su vida emocional y social.
Siempre deberá tenerse en cuenta el principio de prima non nocere, y se deberán explicar al niño y a sus padres los posibles efectos adversos que pueda producir, a corto y largo plazo, la medicación prescrita.
Se comienza siempre con dosis bajas del fármaco elegido y se las va elevando muy lentamente hasta alcanzar la dosis útil terapéutica. No hay que olvidar que la mayoría de los fármacos tienen un período de latencia de 2 a 6 semanas para actuar o estabilizarse en el organismo. Este período puede ser interpretado por los padres o el médico administrador como falta de respuesta del organismo y llevar a incrementar innecesariamente las dosis.
Estas consideraciones son importantes y necesarias para establecer una buena alianza terapéutica con el niño y su familia. El logro de una buena respuesta al tratamiento depende también de las expectativas favorables o desfavorables, conscientes e inconscientes, respecto de la medicación (efecto placebo positivo o negativo) tanto del niño como de sus padres y, en forma más amplia, del entorno escolar y social.
Además de la respuesta al fármaco del niño y su familia, se deberán evaluar posibles repercusiones sobre el aprendizaje, a través de los informes periódicos de los educadores.
Es aconsejable mantener la medicación durante un mínimo de 6 a 12 meses y, en caso de suspenderla, debe hacerse de forma lenta y paulatina. En lo posible se deberá definir con el paciente y la familia, las diferentes etapas del tratamiento y su duración (fase de titulación, fase aguda, fase de mantenimiento, y fase de discontinuación). Esto último es importante sobre todo en las familias que temen que el paciente permanezca «para siempre», con la medicación.
2) Consideraciones acerca del desarrollo del cerebro
Actualmente existe mucho interés en el estudio de las modificaciones del metabolismo cerebral y cambios neuroquímicos que podrían ser la manifestación de un desarrollo biológico anómalo, en el intento de comprender la patogénesis de ciertos trastornos psiquiátricos de inicio temprano (autismo, conductas de auto-mutilación, trastorno de déficit atencional con hiperactivdad y esquizofrenia), en el contexto de vulnerabilidades o características de estadios específicos.
El desarrollo puede definirse como un ordenamiento temporal o una secuencia de estadios biológicos o psicológicos. Tanto la secuencia como el timing de los estadios son importantes para una maduración normal. El estadio se define como un período de tiempo en el cual existen características anatómicas, fisiológicas o relaciones psicológicas que no existen en ningún otro período del desarrollo. Dentro del estadio, existe un estrecho período crítico, una ventana de oportunidad, que es el momento en el que un evento determinado debe ocurrir, del que dependerán subsecuentes eventos madurativos. Una falla en este desarrollo resultaría en un retraso madurativo o en una conducta francamente patológica. El desarrollo del cerebro se produce durante la organogénesis. Los principales precursores de la mayoría de las estructuras cerebrales adultas (lo que luego será el cerebro y la médula espinal), comienzan a diferenciarse alrededor de la tercera semana de gestación.
A continuación se detallan algunos trastornos psiquiátricos de inicio temprano, en los que se especula que podrían ser la manifestación de alteraciones del desarrollo cerebral. Las observaciones clínicas se han visto apoyadas por la investigación en animales que demuestra que lesiones en áreas específicas del cerebro o manipulaciones específicas del ambiente llevan a conductas resultantes que están determinadas en parte, por la edad del animal en el momento de la lesión.
3) Clasificación psicofarmacológica
Los psicofármacos se clasifican en:
1) Estimulantes
2) Antidepresivos
3) Antipsicóticos
4) Carbonato de litio
5) Ansiolíticos
6) Anticonvulsivantes
7) Otros medicamentos (beta-bloqueantes, clonidina, guanfacina, naltrexona, fenfluramina)
1) Estimulantes
Los estimulantes constituyen el principal tratamiento psicofarmacológico del trastorno por déficit de la atención con hiperactividad (TDAH); son los psicofármacos más comúnmente prescritos para los niños en los Estados Unidos; según estimaciones recientes alrededor de 750.000 niños los reciben diariamente.
El TDAH afecta al 5 % de la población escolar, (que puede llegar al 30 % en las muestras clínicas), con una alta tasa de persistencia en la adolescencia y edad adulta (15 % al 60 %).
El trastorno es mucho más frecuente en varones que en mujeres, con proporciones varón/mujer que oscilan entre 4:1 y 9:1 (en función de si la población es general o clínica).
Cuadro 5. Características farmacodinámicas y farmacocinéticas en niños y adolescentes (comparativas con las de los adultos)
Un niño con TDAH se caracteriza por presentar un grado de inatención, impulsividad y frecuentemente hiperactividad que es inapropiado para su estadio de desarrollo. Suelen verse afectadas todas las áreas de funcionamiento: desempeño escolar, conducta y capacidad para las relaciones sociales tanto con adultos como con pares. El TDAH muchas veces se asocia no sólo al trastorno negativista-desafiante y al trastorno disocial, sino también a trastornos depresivos y de ansiedad. Los estimulantes pueden mejorar también los síntomas de TDAH en niños y adolescentes con retraso mental y trastornos del desarrollo.
Se ha registrado un incremento de su empleo en la población de las escuelas secundarias. Esto podría deberse al mayor reconocimiento y tratamiento del TDAH en niños y adolescentes.
Se denominan estimulantes por su capacidad de incrementar el nivel de actividad o alerta del SNC. Son fármacos simpaticomiméticos de estructura similar a la de las catecolaminas endógenas.
* Consideraciones farmacodinámicas y farmacocinéticas
Los estimulantes poseen potentes efectos agonistas sobre receptores alfa y beta adrenérgicos:
– actúan como agonistas directos e indirectos,
– a nivel presináptico producen liberación de noradrenalina y dopamina,
– a nivel postsináptico actúan como agonistas directos,
– bloquean la recaptación de noradrenalina y dopamina por el terminal presináptico.
En cuanto al incremento de la liberación de neurotrasmisores, los distintos estimulantes actuarían en sitios diferentes a nivel de la neurona presináptica. Por ej. la liberación de dopamina mediada por la D-anfetamina puede ser bloqueada por la a-metiltirosina, pero no por la reserpina, sugiriendo que la dopamina proviene de un pool citoplasmático de síntesis reciente. La liberación de dopamina por el metilfenidato puede ser bloqueada por pretratamiento con reserpina, y sería de origen vesicular.
Un modelo de acción para explicar los efectos de los estimulantes en el TDAH propone que se ejerce a través de la influencia inhibitoria cortical frontal que actúa a su vez sobre las estructuras inferiores (núcleo estriado). La dopamina actuaría en el núcleo accumbens limitando la información que debe ser procesada desde el hipocampo hacia la corteza prefrontal, permitiendo focalizar la atención. La corteza prefrontal no modularía adecuadamente al locus coeruleus por disminución de las catecolaminas (dopamina y noradrenalina). La desinhibición y aumento del «firing» del locus coeruleus se manifiesta en el ingreso excesivo de estímulos rutinarios e irrelevantes, con el consiguiente incremento de la información que debe ser procesada, dificultades para seleccionar estímulos pertinentes y aumento de la distracción. La serotonina también podría estar implicada, pues su actividad está relacionada con el control de las conductas impulsivas y agresivas. Por todo esto, no pueden sostenerse los modelos etiológicos del TDAH que plantean el déficit de un único neurotrasmisor (teoría hipodopaminérgica).
En estudios realizados con PET (tomografía por emisión de positrones), en adultos con antecedentes de TDAH, se encontró una disminución del 8.1 % en el metabolismo cerebral de la glucosa en relación a los controles, sobre todo a nivel de la corteza prefrontal y áreas premotoras. Estudios recientes del flujo cerebral muestran que, durante el tratamiento con estimulantes, se incrementan tanto la actividad en el estriado como las conexiones entre la región órbito-frontal y límbica.
La tomografía por emisión de positrones demostró un aumento del metabolismo en las áreas órbito-frontales bilaterales y en las sensoriomotoras parietales izquierdas, luego de una dosis única de metilfenidato. También se observó la supresión de la actividad en el área temporal izquierda.
En estudios con RMN (resonancia magnética nuclear), se midió el área del cuerpo calloso en 15 niños con TDAH y en 15 niños sin trastornos psiquiátricos, encontrándose que dos de siete áreas anatómicas eran significativamente más pequeñas en los niños con TDAH; los autores concluyen que esto implicaría un desarrollo y funcionamiento anormal del lóbulo frontal en el TDAH.
Los estimulantes disponibles son: de acción corta, el metifenidato y la d-anfetamina, y uno de acción más prolongada, la pemolina de magnesio.
Se deben explicitar algunos mitos o creencias populares, concernientes al tratamiento con estimulantes, ya que éstos:
1) No tienen efecto paradojal sedativo
2) No causan adicción
3) Están indicados y son efectivos después de la pubertad
4) No disminuyen el umbral convulsivo
No existen predictores que permitan saber cuál de los tres estimulantes será el más beneficioso para un niño particular.
El metilfenidato es un derivado ciclizado de la anfetamina, sintetizado en 1944, que actúa de manera preponderante sobre la actividad dopaminérgica. Es el más utilizado y el mejor estudiado y es muy efectivo en reducir la hiperactividad motora.
La D-anfetamina es probablemente la que presenta la «peor imagen» y algunas farmacias se niegan a tener stock (por temor a los robos y a su potencial de abuso).
El metilfenidato y la D-anfetamina presentan un inicio de su acción a los 30-60 minutos de administrados y el pico del efecto clínico ocurre entre 1-3 horas.
Por su vida media corta deben administrarse en dosis divididas a lo largo del día, con intervalos de 4 horas. Los horarios convenientes para administrar el metilfenidato y la D-anfetamina son: luego del desayuno, antes de partir para el colegio (8 AM), y luego del almuerzo (12 PM), para asegurar un nivel plasmático adecuado en las horas de escuela.
Algunos niños pueden requerir una dosis adicional a las 4 PM cuando realizan sus tareas, pero puede ocurrir insomnio, por lo que deberán en todo momento evaluarse los costos/ beneficios.
En EE.UU. existen presentaciones de liberación lenta con acción prolongada, tanto del metilfenidato como de la D-anfetamina, pero no han aparecido aún en nuestro país.
La pemolina, por su vida media más larga, puede darse en dosis matinal única y tiene menor efecto rebote al atardecer (aunque algunos niños pueden requerir dos dosis diarias). En contraste con observaciones clínicas previas que sugerían que su acción terapéutica no aparece antes de las 3 a 4 semanas, actualmente la pemolina ha demostrado ser efectiva luego de la primera dosis.
Se ha descrito la aparición de movimientos coreiformes de cara, tronco y extremidades, y movimientos anormales bucolinguales en niños a los que se les habían aumentado las dosis de pemolina de forma rápida.
También se ha observado, en forma poco frecuente, hepatitis inducida por pemolina, por lo que deberán monitorizarse las enzimas hepáticas.
Un importante número de niños puede responder a un estimulante pero no a otro, por lo que luego del fracaso con uno de ellos, deberá intentarse con los otros.
Dosificación
La administración de los estimulantes con o inmediatamente después de las comidas, podría incrementar su absorción, y evitar la disminución del apetito (efecto anorexígeno).
No se ha demostrado la utilidad del dosaje de niveles plasmáticos de los estimulantes, ya que por su vida media tan corta no presentan un verdadero estado estacionario, y su efecto clínico estaría más relacionado con la fase de absorción, cuando la concentración plasmática se eleva rápidamente. El efecto sobre la conducta parece ser proporcional a la tasa de absorción.
La tolerancia a los efectos de los estimulantes sobre la atención, actividad, impulsividad, y relación con los pares no ha sido demostrada y proviene de observaciones realizadas antes de 1983. En estudios recientes de pacientes tratados por más de 6 meses no se evidenció tolerancia. En los casos en que pareciera disminuir el efecto de la medicación, conviene re-evaluar la compliance, (los padres pueden olvidar alguna dosis, perder las prescripciones y ajustar las dosis según su criterio cuando ven que el niño mejora, por temor a que la medicación sea dañina) y también considerar situaciones estresantes que puedan estar ocurriendo en el hogar o en la escuela.
Otro elemento a ser tenido en cuenta es la autoinducción del metabolismo hepático lo que puede requerir un incremento del 10-20 % luego de algunos meses de tratamiento. También deberán efectuarse correcciones en función del crecimiento del niño y de su aumento de peso, ya que en estudios recientes se observó que cuando se van ajustando las dosis por peso corporal, no disminuyen los efectos terapéuticos (las dosis permanecen constantes por kg/d).
Los efectos en los que sí se observan tolerancia se refieren a la pérdida del efecto supresor del apetito y efectos cardiovasculares (aumento de frecuencia cardíaca y presión arterial), que suelen desaparecer al cabo de algunas semanas.
Algunos estudios iniciales parecían indicar una diferencia en las dosis requeridas para obtener efectos sobre el aprendizaje y la conducta en niños hiperactivos (disociación entre respuesta cognitiva y social). Específicamente, se consideraba que dosis más bajas de 0,3 mg/kg de metilfenidato producirían la máxima mejoría sobre el aprendizaje, mientras que las dosis más altas eran beneficiosas para los trastornos de conducta con detrimento sobre el aprendizaje.
Estudios actuales, por el contrario, han demostrado que las dosis entre 0,3 y 2,0 mg/kg/día mejoran, de forma óptima, tanto el desempeño académico-cognitivo como el conductual.
Indicaciones
La indicación más importante es el trastorno por déficit de atención con hiperactividad, en niños y adolescentes (también es eficaz en adultos) con su trastornos de comorbilidad asociados (trastornos del aprendizaje y del desarrollo).
También se lo ha ensayado en el retraso mental.
Efectos adversos
Los efectos adversos más frecuentes son las alteraciones del sueño (dificultad para conciliar el sueño) y la disminución del apetito (que se controla con cambios en los horarios de administración del fármaco), disforia, irritabilidad y efecto rebote.
La disforia e irritabilidad que ocurren 1-2 horas después de la administración, pueden indicar una dosificación excesiva, pero si ocurren hacia el final del período efectivo (5 a 15 horas después de la última toma), pueden mostrar un fenómeno de discontinuación (retiro). En estos casos puede ser necesario agregar una pequeña dosis a la tarde. El efecto rebote también puede ocurrir interdosis en algunos niños.
Sólo en un 3,6 % de los niños fue necesario suspender el tratamiento por los efectos adversos.
Otros efectos adversos menos frecuentes son: cefaleas, vértigos, irritabilidad, sensibilidad emocional, llanto fácil, molestias abdominales, somnolencia y fatiga y movimientos coreiformes (pemolina).
Los únicos efectos adversos cardiovasculares estudiado de los estimulantes fueron un ligero incremento en el pulso y la presión arterial, sin importancia clínica.
Se ha visto la aparición de psicosis tóxica (con alucinaciones visuales), cuando se los administra en dosis altas de forma rápida, pero ello es muy poco frecuente (fue reportada en 30 casos) y sobre todo con D-anfetamina. Este tipo de psicosis difiere de la exacerbación de los síntomas psicóticos de la esquizofrenia (por lo que debe evaluarse cuidadosamente para descartar un trastorno psicótico previo).
Con pemolina se han descrito reacciones de hipersensibilidad acompañadas de incremento de las enzimas hepáticas por lo que deberá realizarse un hepatograma basal y repetirlo cada 6 meses.
La aparición o exacerbación de tics, luego de la administración de estimulantes es un motivo de preocupación. En el caso de TDAH asociado a tics, se deberá utilizar tratamiento no-estimulante (antidepresivos tricíclicos o clonidina), que se describirá más adelante. En pacientes con epilepsia, se usarán anticonvulsivantes en forma concomitante.
En el largo plazo, los efectos adversos más importantes están asociados con el crecimiento. Algunos niños disminuyen la velocidad de crecimiento al ser tratados con estimulantes, pero en general no influyen en la estatura final y casi todos los casos llegan a los valores pronosticados de acuerdo con la estatura de los padres.
No suele ser necesaria una interrupción de fin de semana o de vacaciones, que genera deterioro en la vida social y familiar del niño. Se desconoce el mecanismo por el cual los estimulantes retrasan la curva de crecimiento. Las teorías iniciales lo atribuían a una acción supresiva sobre la secreción de hormona de crecimiento y de prolactina pero estudios recientes, tanto con D-anfetamina como con metilfenidato, no demostraron cambios en la secreción de hormona de crecimiento. Las explicaciones aceptadas actualmente se relacionan con la disminución del apetito, que produciría una restricción calórica, aunque no se han estudiado en forma sistemática la ingestión calórica de niños con TDAH, tratados con estimulantes. En algunos casos sin embargo, se deberá considerar una medicación alternativa.
Hay que prestar especial atención a la posibilidad de que ocurra una disminución de la autoestima, burlas de los compañeros, dependencia de los padres y maestros en relación al fármaco, que deberán ser abordados psicoterapéuticamente. Tanto el niño como los adultos deberán ser instruidos acerca de que la medicación le permite al niño realizar lo que desea, pero no lo «obliga» a hacer nada. Los pacientes deberán recibir todo el crédito por sus mejorías y ser ayudados en tomar la adecuada responsabilidad por los problemas que provocan. (puede ser útil el ejemplo de los anteojos).
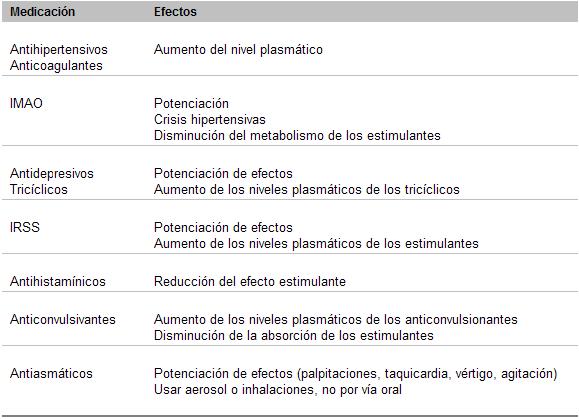
Interacción de los estimulantes
(Modificado de Wilens y Biederman, 1992)
Contraindicaciones
Están contraindicados en casos de ansiedad intensa, agitación, procesos psicóticos, hipersensibilidad conocida, síndrome de Tourette, tics motores, antecedentes familiares de tics.
Toxicidad y sobredosis
Los estimulantes son fármacos seguros, con una dosis letal media (LD 50), de 367 mg/kg por vía oral para el metilfenidato, y de 55 mg/kg para la anfetamina.
No se ha comprobado su potencial adictivo en niños y adolescentes con TDAH; la más euforizante es la anfetamina, seguida por el metilfenidato y la pemolina.
2) Antidepresivos
Estudios abiertos y controlados han informado acerca de los efectos beneficiosos de los antidepresivos en niños y adolescentes con TDAH, trastorno obsesivo-compulsivo (TOC) y enuresis. Otras condiciones que se pueden beneficiar con el tratamiento con antidepresivos incluyen depresión, ansiedad, tics.
Los antidepresivos pueden clasificarse en cuatro grupos principales: los más estudiados son los tricíclicos (TC), entre éstos, en especial la imipramina, los inhibidores selectivos de la recaptación de serotonina (IRSS), los inhibidores de la monoamino oxidasa (IMAO) y finalmente un grupo de antidepresivos nuevos como la venlafaxina, el bupropion, la mianserina, la mirtazapina, el trazodone, el nefazodone, la tianeptinao. Sobre estos últimos aún no existe suficiente información sobre su uso, eficacia y toxicidad en niños y adolescentes (ver cap. 6).
* Consideraciones farmacodinámicas o farmacocinéticas
Algunos estudios sugieren que los antidepresivos tricíclicos serían menos efectivos en niños y adolescentes que en adultos. Ello se atribuye a las diferencias en el medio hormonal del cerebro y a la maduración incompleta de los sistemas de neurotrasmisión involucrados en el control del afecto, además de las diferencias farmacodinámicas y farmacocinéticas.
Los fármacos utilizados, en la mayoría de los estudios, son inhibidores puros o que actúan de manera preponderante sobre la recaptación noradrenérgica.
Por ejemplo, la nortriptilina y la desimipramina, los tricíclicos más estudiados, son compuestos relativamente noradrenérgicos puros. En cambio, con respecto a la imipramina y a la amitriptilina, una vez metabolizados sus compuestos originales por vía hepática, quedan más metabolitos con actividad noradrenérgica, siendo la relación final entre la actividad noradrenérgica y serotoninérgica más alta que la que se observa en adultos.
Esta variación es significativa, porque el sistema noradrenérgico no se desarrolla totalmente anatómica ni funcionalmente hasta la adultez. En consecuencia, fármacos con acciones adrenérgicas no pueden desarrollar un efecto completo.
En la adolescencia existe un período con altos niveles de cetosteroides, que tienen efectos significativos sobre el sistema noradrenérgico central. En consecuencia, si bien la depresión en niños y adolescentes sería etiológicamente similar a la de los adultos, la respuesta clínica a los antidepresivos es menor, cuando se la compara con la de los adultos.
Los tricíclicos se metabolizan más rápidamente en niños y adolescentes que en adultos. Existe menor unión a las proteínas plasmáticas que en adultos.
La biotransformación hepática de los TC implica mecanismos de oxidación, hidroxilación y dimetilación. En los adultos existe una amplia variación interindividual, hasta 30 veces, en los niveles plasmáticos para una dosis dada. Esto mismo ocurre en los niños, con un 5-10 % aproximadamente de «hidroxiladores lentos», que por lo tanto tienen una vida media muy prolongada.
Siempre es conveniente indicar las tomas de manera fraccionada, varias veces en el día, para evitar las oscilaciones en las concentraciones plasmáticas, como resultado del rápido metabolismo. El control de los niveles plasmáticos puede ayudar a diferenciar los metabolizadores lentos -que tendrán niveles tóxicos con dosis bajas- de los metabolizadores rápidos -que requerirán de mayores dosis para alcanzar un nivel terapéutico eficaz-.
Los niños tienen una mayor capacidad hepática en relación con su talla; por ello metabolizan más rápidamente los fármacos que utilizan esa vía y requieren de dosis relativas mayores que en los adultos (2-3 mg/kg); en ciertos casos se deberá llegar hasta 5 mg/kg/día.
La vida media de los fármacos es más corta que en los adultos, y requieren de un mayor tiempo de administración para tener efectos terapéuticos. A diferencia de lo observado en los adultos, cuyo tiempo de latencia varía de 2 a 4 semanas, en los niños a veces se ha de esperar hasta 4 o 6 semanas.
En los adultos, debido al mayor volumen del tejido adiposo, los fármacos y sus metabolitos se almacenan durante más tiempo. En cambio los niños están más expuestos a los fenómenos de abstinencia, cuando se discontinúan los antidepresivos de manera abrupta.
Se debe descartar el fenómeno de abstinencia por omisión de alguna dosis, e inclusive cuando se los administra en una sola toma diaria, cuando aparece un cuadro de tipo gripal, con síntomas gastrointestinales (náuseas, vómitos, dolor de estómago, malestar general, cefalea, fiebre, decaimiento).
La discontinuación de los antidepresivos tricíclicos se debe hacer de forma gradual, en un período mínimo de 2 semanas.
Por las grandes variaciones interindividuales en la metabolización de los TC, la administración de dosis fijas no es del todo conveniente: en los metabolizadores rápidos no habrá respuesta, y los lentos presentarán toxicidad.
Se han realizado tablas que permiten predecir, 24 horas después de la administración de una dosis única, la respuesta a partir del dosaje plasmático del fármaco. El objetivo más importante de estas tablas es prevenir la toxicidad en el niño metabolizador lento (no existe manera de detectarlos previamente).
Se sugiere repartir las dosis de antidepresivos TC en dos a tres tomas diarias, para evitar un pico plasmático elevado: comenzar con 1,0 mg/kg (10 a 25 mg) y ajustar lentamente la posología mediante aumentos de 1 mg/kg cada 4 o 5 días.
Desimipramina y muerte súbita
La preocupación acerca de la cardiotoxicidad de los TC se ha incrementado, pues entre 1987 y 1990 ocurrieron muertes súbitas en cuatro niños y adolescentes medicados con desimipramina.
El único caso publicado anteriormente ocurrió en 1974 y se trató de una niña de 6 años que recibió 14.7 mg/kg/día de imipramina. A partir de ahí, la FDA ordenó en los EE.UU., no sobrepasar los 5 mg/kg/día. Sin embargo, los cuatro casos recientes ocurrieron con las dosis y niveles plasmáticos aceptados.
Las características de los cuatro casos fueron los siguientes:
1) Un niño de 8 años, con 2.56 mg/kg/día de desimipramina, falleció luego de correr en un día caluroso. El nivel plasmático post-mortem fue de 85 ng/mI. El ECG pre-mortem fue normal. Varios familiares por línea materna habían fallecido súbitamente antes de los treinta años.
2) Un niño de 8 años sin anomalías cardíacas conocidas con una dosis de desimpramina no conocida, falleció súbitamente en su casa. El nivel plasmático pre-mortem fue de 10 ng/ mI.
3) Un niño de 9 años falleció mientras corría. Se desconoce la dosis de desimipramina. El nivel plasmático pre-mortem fue de 120 ng/ml. Su ECG previo fue normal. Su madre había fallecido post-parto por insuficiencia cardíaca congestiva.
4) Una niña de 12 años, con 3.1 mg/kg/día de desimipramina fue hallada inconsciente luego de jugar al tenis. Fracasaron los esfuerzos por reanimarla.
En resumen:
a) todos los casos ocurrieron con desimipramina, el TC con mayor efecto noradrenérgico,
b) todos los casos ocurrieron con niveles plasmáticos aceptados,
c) tres casos ocurrieron luego de realizar ejercicios, y
d) dos casos presentaban antecedentes familiares de muerte súbita y enfermedad cardíaca familiar.
Se ha postulado que un síndrome de QT prolongado podría subyacer a estas muertes. Esto ocurre con antiarrítmicos clase IA y TC. El síndrome de QT prolongado se asocia con torsades de pointes, que es una taquiarritmia ventricular multifocal, que puede desembocar en una fibrilación ventricular. Tanto la desimipramina como el ejercicio, aumentan el tono noradrenérgico y serían la causa de estas muertes. Se encontró que la desimipramina produce un pequeño pero estadísticamente significativo aumento en los intervalos PR, QRS y QT del ECG. No hay estudios en niños y adolescentes de ECG de esfuerzo, que pueden detectar la prevalencia de arritmias ocultas.
Algunos autores americanos, utilizaron bases de datos epidemiológicos nacionales para analizar la relación entre el número de muertes súbitas por causas desconocidas y el número de prescripciones de desimipramina de los últimos años. La conclusión fue que si bien el factor de riesgo aumentaba de 2 a 3, el rango de muerte súbita seguía siendo bajo (8 a 12/millón de niños/ año), por lo que el uso de desimipramina podía considerarse seguro.
En el Centro Médico de la Universidad de Pittsburg, se elaboró una guía para el uso de TC en niños y adolescentes con la recomendación de obtener un ECG basal antes de iniciar el tratamiento con TC para detectar anomalías congénitas de la conducción, y luego repetirlo con cada incremento de dosis, y al llegar al estado estacionario. La dosis máxima no debe exceder los 5 mg/ kg/día.
Las dosis habituales se encuentran entre 2,0 y 5,0 mg/kg (1,0-3,0 mg/kg para la nortriptilina). Debido a la letalidad de los TC en sobredosis, los padres deben ser advertidos de guardar la medicación fuera del alcance de los niños.
Los niveles plasmáticos recomendados para la nortriptilina son de 60 a 150 ng/ml, para la imipramina + desimipramina son de 125 a 250 ng/ml y para la desimipramina, entre 150 y 300 ng/ml (con dosis que oscilan entre 2,5 y 5 mg/ kg/día).
La clomipramina tiene una vida media larga, 32 horas, para una dosis única de 150 mg. Su principal metabolito, la desmetilclomipramina, que puede llegar a las 69 horas. Recientemente la FDA ha aprobado su uso en niños mayores de 10 años para el tratamiento del TOC, en dosis iniciales de 25 mg/d, hasta un máximo de 3 mg/kg/d.
Los IMAO no suelen utilizarse en el tratamiento de niños y adolescentes por que se requieren restricciones alimentarias que suelen presentar problemas en este grupo etario. Tal vez no se preocupen por no poder comer anchoas, quesos estacionados, vinos chiantis o hígado, pero suelen engullir grandes cantidades de chocolate y pizza. Además suelen utilizar frecuentemente medicamentos de venta libre para la tos y resfríos que contienen simpaticomiméticos.
Estas interacciones pueden inducir graves crisis hipertensivas, que según algunos autores pueden presentarse hasta en un 30 % de los pacientes que recibieron IMAO A-B (por ingesta accidental o intencional).
Sin embargo se han utilizado con éxito en pacientes resistentes que no respondieron a los TC, y en niños y adolescentes con depresiones atípicas (en casos en que tanto el paciente como la familia eran responsables y confiables). Las dosis oscilaron entre 0.54.0 mg/kg, repartidas en 2-3 tomas.
La moclobemida (IMAO A, selectivo y reversible), no ha sido suficientemente estudiada en niños, y podría estar indicada en adolescentes con trastorno distímico. Las dosis utilizadas fueron 150-600 mg/día, repartidas en 2-3 tomas.
Ha habido reportes promisorios acerca de la utilidad del IMAO-B, Ldeprenyl, en TDAH asociado a Tr. de Tourette. La dosis utilizada fue de 15 mg (70-214 ug/kg), repartidos en dos tomas.
Los IMAO nunca deben asociarse a los IRSS pues se han informado de casos fatales por síndrome serotonérgico.
Los IRSS incluyen la fluoxetina, paroxetina, sertralina, citalopram y fluvoxamina. Debido a su perfil farmacológico no presentan efectos cardiotóxicos, tienen menor efecto anticolinérgico, sedativo, producen menor aumento de peso que los TC y son seguros en sobredosis. Presentan diferencias entre sí en cuanto a las características farmacocinéticas, vida media, metabolitos activos, y capacidad de inhibir los citocromos hepáticos (ver cap. 5).
Para los IRSS y los nuevos antidepresivos no se han establecido los márgenes de la posología y su seguridad y eficacia no han sido suficientemente estudiados en niños y adolescentes, por lo que las dosis indicadas deberán considerarse como meras sugerencias basadas en la escasa literatura existente.
Indicaciones
Tr. Depresivo mayor
Depresión atípica
Trastorno bipolar, episodio depresivo
TDAH
Fobia escolar, fobia social
Ansiedad de separación
Trastorno por ansiedad tipo adulto (ataques de pánico, agorafobia)
Trastorno obsesivo-compulsivo (TOC)
Bulimia-anorexia
Trastornos del sueño (narcolepsia, apnea del sueño, parasomnias: terrores nocturnos, sonambulismo, pesadillas)
Síndrome de Tourette
Los efectos adversos, contraindicaciones e interacciones son similares a los de los adultos.
Es necesario acotar que los efectos anticolinérgicos de los TC pueden disminuir la producción de saliva y facilitar la aparición de caries, por lo que se debe recomendar el control odontológico periódico.
En pacientes con alteraciones cardiovasculares o antecedentes familiares de muerte súbita, es necesario un estricto control electrocardiográfico y los que presenten historia de convulsiones, deberá vigilarse su administración, debido a que reducen el umbral convulsivo.
3) Antipsicóticos
A diferencia de los adultos, donde la principal indicación de los antipsicóticos es la psicosis, en los niños se los suele indicar, además, en los trastornos no psicóticos.
El mayor conocimiento de las disquinesias tardías y los efectos adversos sobre los procesos cognitivos, así como el advenimiento de nuevos fármacos han ido limitando su prescripción. Son los fármacos de primera elección en la esquizofrenia, el trastorno autista y el síndrome de Tourette. Se utilizan también en niños severamente agresivos y con trastornos de conducta y frecuentemente en pacientes institucionalizados, con retraso mental.
El término psicosis se utiliza generalmente para describir conductas anormales de niños con el juicio de realidad severamente perturbado. Para el diagnóstico de psicosis se requiere la presencia de delirios y alucinaciones (visuales, auditivas, táctiles). Los trastornos psicóticos en niños, al igual que en los adultos, pueden ser funcionales u orgánicos. Las psicosis funcionales comprenden la esquizofrenia y los trastornos relacionados, y las formas psicóticas de los trastornos del ánimo. Las psicosis orgánicas pueden desarrollarse secundariamente a lesiones del SNC, como consecuencia de una enfermedad médica, traumatismo, abuso de sustancias.
Actualmente se los clasifica en antipsicóticos típicos (los clásicos neurolépticos, de baja y alta potencia) y los nuevos antipsicóticos atípicos (clozapina, risperidona y olanzapina) (ver cap. 2).
Consideraciones farmacodinámicas y farmacocinéticas
Los niños y los adolescentes metabolizan y excretan con más eficiencia los antipsicóticos que los adultos, pues con dosis comparables aparecen menores concentraciones plasmáticas. La vida media de clorpromazina y haloperidol se encontró disminuida en niños, en relación a los adultos. Pero, a pesar de su metabolización más rápida, no se requieren dosis más altas, sino más bajas para alcanzar los mismos efectos terapéuticos.
A pesar de que existen pocos datos disponibles, los datos clínicos demuestran que los niños y adolescentes son más sensibles que los adultos a los efectos terapéuticos y a los efectos adversos. Esta diferencia de respuesta al tratamiento neuroléptico sería del orden farmacodinámico, a nivel del desarrollo del cerebro, pues se encontró que en los niños habría una mayor densidad de receptores dopaminérgicos DI y D2.
Algunos autores encontraron grandes variaciones en la concentración plasmática de la clorpromazina para una dosis dada y niveles plasmáticos 2 a 3,5 veces más bajos en niños y adolescentes que en adultos para una determinada dosis por kg de peso corporal.
La mejoría clínica en estos niños comenzaba con niveles plasmáticos de clorpromazina de 30 ng/ml; el rango óptimo se encuentra entre los 40 y 80 ng/ml (para los adultos se considera entre 50 y 300 ng/ml). También se observó que los niveles plasmáticos de clorpromazina declinaban a lo largo del tiempo en pacientes tratados con dosis fijas, tal vez por autoinducción enzimática.
En general, no se recomienda en niños y adolescentes la vía intramuscular
o intravenosa. La vía intravenosa puede ser cardiotóxica si la inyección es muy rápida y la extravasación puede producir necrosis tisular. La vía intramuscular puede ser muy irritante.
Tampoco se recomiendan los preparados de depósito, pues no se conocen ni su eficacia ni su seguridad en este grupo etario. Podrían estar indicados en adolescentes con poca compliance a los neurolépticos clásicos.
Aunque químicamente los neurolépticos son muy distintos, con dosis equivalentes parecerían tener una respuesta similar; sin embargo, algunos pacientes responden mejor a algunos que a otros.
Los antipsicóticos atípicos como la clozapina, la risperidona y la olanzapina (antagonistas dopamina-serotonina), son más efectivos que los antipsicóticos típicos en el tratamiento de los síntomas negativos, presentan menos efectos adversos y suelen ser eficaces en pacientes resistentes.
La clozapina parece tener numerosas ventajas sobre los neurolépticos clásicos, con una eficacia superior en el tratamiento de los síntomas positivos y negativos, en pacientes con o sin resistencia a otros neurolépticos. Se ha informado entre un 30-60 % de eficacia en esquizofrénicos resistentes al tratamiento. No se han descrito disquinesias tardías, ni galactorrea, amenorrea (no aumenta los niveles de prolactina), bajísima incidencia de efectos extrapiramidales y acatisia, y mejoría en el funcionamiento cognitivo Existen ya numerosos trabajos que demuestran la eficacia de la clozapina en niños y adolescentes. Deben realizarse controles semanales de glóbulos blancos, pues puede ocurrir agranulocitosis en el 0.5 al 2 % de los pacientes. Citando se superan los 300 mg/día el riesgo de convulsiones llega al 5 % por lo que se deben efectuar EEG de control.
La risperidona no ha sido tan estudiada, porque su aparición es más reciente, pero parece ser muy efectiva. Deben monitorearse las enzimas hepáticas pues se han descrito aumento de peso asociado a anomalías en el hepatograma e hígado graso en dos varones, que se normalizó al suspender el tratamiento y bajar de peso.
Dosificación
Los neurolépticos se utilizan en una gran variedad de trastornos y por su amplia aplicación en psiquiatría, frecuentemente se los utiliza incorrectamente, con una única dosificación para todos los trastornos.
En general, las dosis terapéuticas que se requieren para los trastornos no psicóticos son más bajas que para los psicóticos. Por eso es útil plantearse una estrategia que define tres rangos de dosis para distintos trastornos.
En este algorritmo también está implícito el «timing» de la titulación, pues frente a un tr.de Tourette, hay que comenzar con bajas dosis y subir muy lentamente, pues de lo contrario los efectos adversos pueden ser peores que los mismos tics. Por el contrario, en un paciente con una psicosis aguda se debe ir más rápido para evitar un sufrimiento inútil y resolver pronto los síntomas, para que éstos no se cronifiquen o se vuelvan resistentes por sub-medicación.
Debido a la vida media larga de los neurolépticos se pueden repartir las dosis en una o dos tomas diarias. Al principio, es conveniente dividir las dosis en dos o más tomas para evitar las distonías agudas. Luego se podrá indicar una dosis única por la noche para evitar la sedación diurna.
La mejoría de los síntomas positivos en la esquizofrenia sigue un curso temporal; en las primeras 2 semanas ocurre sedación y los síntomas positivos van disminuyendo gradualmente en 4-6 semanas, pudiendo continuar la mejoría a lo largo del primer año, aunque pueden persistir algunos síntomas positivos y negativos.
Indicaciones
– Trastornos psicóticos (esquizofrenia, psicosis tóxica, síntomas psicóticos en tr. afectivos severos, manía aguda)
– Trastornos no psicóticos
Síndrome de Tourette
TDAH resistente
Agresión y autoagresión e hiperactividad en los trastornos de conducta y en los trastornos del desarrollo con retraso mental
Autismo
Inestabilidad emocional en trastornos de la personalidad.
Efectos adversos
En general, se previenen incrementando lentamente las dosis. No deberán administrarse agentes antiparkinsonianos de forma profiláctica, ya que disminuyen las concentraciones plasmáticas de los antipsicóticos. Aproximadamente el 50 % de los niños tratados con neurolépticos desarrollan algún tipo de efectos adversos extrapiramidales.
Las distonías agudas aparecen precozmente, entre horas y 5 días, luego del incremento de dosis del antipsicótico administrado. Los varones presentan mayor riesgo de desarrollarlas. Los síntomas que pueden asustar al paciente, sobre todo si no entiende lo que le está ocurriendo, incluyen: hipertonía muscular, espasmos del cuello (tortícolis), boca y lengua, crisis óculogiras, opistótonos y, suelen responder rápidamente a los anticolinérgicos y antiparkinsonianos como la difenhidramina (25-50 mg) o el biperideno (1-2 mg), administrados oral o intramuscularmnente.
Los síntomas parkinsonianos incluyen aquinesia, temblor, inexpresividad facial, signo de la rueda dentada. El período de mayor riesgo es entre los 5 y 30 días de iniciado el tratamiento. Son más frecuentes en mujeres y, a medida que aumenta la edad.
La aquinesia es el enlentecimiento para iniciar movimientos con falta de espontaneidad. Se la considera la forma más severa de parkinsonismo. Se debería a un efecto tóxico de los antipsicóticos, interfiere con la sociabilidad del paciente y a veces parece una «depresión post-psicótica». También es particularmente difícil diferenciarla de los síntomas negativos.
Suelen responder a la medicación antiparkinsoniana, generalmente repartida en 2-3 tomas diarias.
Se debe intentar suspender gradualmente los antiparkinsonianos al cabo de 2-3 meses, para evaluar si persiste la necesidad de su utilización.
Siempre que sea posible, es preferible como primera medida frente a estos efectos adversos, la disminución de la dosis. En un estudio, el 34 % de los niños y los adolescentes (entre 10 y 18 años) presentaron síntomas que desaparecieron al disminuir la dosis.
La acatisia aparece generalmente entre los 5-60 días, en el 1,2 al 11 % de los niños, y su incidencia aumenta después de los 20 años. Es una sensación subjetiva de inquietud motriz, tensión en los miembros inferiores, acompañada de una necesidad urgente e irresistible de moverlos, e incapacidad de permanecer sentado. La acatisia suele estar asociada a disforia, exacerbación de síntomas psicóticos y a veces a ideación y conducta homicida y suicida.
Los pacientes que presentan acatisia son más proclives al abandono del tratamiento. Primero se debe intentar disminuir la dosis (a veces es difícil reconocer la acatisia y se tiende a aumentar las dosis, por confundirse con los síntomas de agitación y ansiedad psicótica). La respuesta a los antiparkinsonianos es variable, y se recomienda el uso de propranolol, un antagonista betaadrenérgico de acción central (1 a 5 mg/kg/d) y de benzodiazepinas de alta potencia, como el clonazepam (0.5 mg/día).
La prevalencia de disquinesia tardía puede ser inducida por la toma o el retiro de neurolépticos. Oscila entre 0 y 51 % según distintos informes, por lo que hay que ser muy cuidadoso en la administración prolongada de neurolépticos. Los síntomas de disquinesia tardía más típicos, incluyen: movimientos involuntarios coreoatetósicos, que afectan la cara, lengua, musculatura perioral, bucal y masticatoria, y cuello y algunas veces también el torso y las extremidades. Ocurren mientras el paciente está recibiendo la medicación y debe distinguirse de la disquinesia de retiro, que ocurre al discontinuar abruptamente la medicación o al disminuir la dosis, que suelen ser benignas y desaparecen al cabo de algunos meses. En algunos casos pueden tardar hasta 3 años en desaparecer.
Pareciera que el riesgo de desarrollar disquinesias tardías irreversibles se incrementa tanto con la dosis acumulada como con la duración del tratamiento. El movimiento vermiforme de la lengua puede ser un signo temprano de disquinesia tardía y la suspensión de la medicación en ese momento puede evitar el desarrollo posterior del síndrome. Para mejorar la sintomatología, se debe disminuir o suspender la medicación antipsicótica, siempre que el cuadro clínico para el que fue utilizada, lo permita. No existe tratamiento adecuado y los antiparkinsonianos empeoran el cuadro. Existen evidencias que la clozapina puede disminuir o eliminar los síntomas de disquinesia tardía, pero reaparecen cuando se la suspende.
En un estudio se comprobó que desarrolló disquinesias tardías el 30 % de niños autistas tratados con haloperidol (20 % mientras lo recibían y 80 % al discontinuarse la medicación). La disquinesia apareció a los 14 días de discontinuada o disminuida la dosis del haloperidol. Los movimientos cesaron espontáneamente a los 7 días y, en algunos casos, duraron hasta 7 meses y medio.
Otro fenómeno asociado a la interrupción de los antipsicóticos es la psicosis de supersensibilidad o exacerbación de los problemas de conducta, de la irritabilidad o de la agresividad en niños y adolescentes no psicóticos que presentan retraso mental.
Ocurren generalmente en las primeras 8 semanas de retirado el neuroléptico. Una forma de reducir estos «síntomas de abstinencia» consiste en disminuir muy lentamente los antipsicóticos a lo largo de varios meses.
También deberá tenerse en cuenta la disminución M umbral convulsivo con los neurolépticos de baja potencia (en especial, con la clorpromazina), en particular en niños con retraso mental.
Se han informado casos de muerte súbita, pero no han sido establecidos con certeza, sobre todo con fenotiazinas de baja potencia.
Con la tioridazina se han encontrado anormalidades cardiológicas como aumento de la frecuencia cardíaca, trastornos de la repolarización, prolongación de los intervalos PR, QT, de la onda T y depresión del segmento ST. Salvo cuando se trata de niños con enfermedad cardíaca preexistente, estos fenómenos carecen de importancia clínica.
La pimozida también produce cambios en el ECG (en el 25 % de los niños, a la semana del tratamiento): inversión de la onda T, ondas U, prolongación del QT y bradicardia. La dosis no debe exceder de 0,3 mg/kg/d.
No se ha comprobado que los neurolépticos afecten los procesos cognitivos y de aprendizaje, salvo que por la sedación interfieran el estudio.
Los neurolépticos tienen índice terapéutico muy alto (relación entre dosis tóxica y terapéutica). La sobredosis, accidental o voluntaria, no suele ser letal, excepto con la tioridazina y la pimozida, por su cardiotoxicidad.
4) Carbonato de Litio
A pesar del amplio uso del carbonato de litio en los adultos, existen pocos estudios bien documentados respecto de su empleo en niños y adolescentes. La indicación más importante es en el tratamiento de los trastornos bipolares infanto-juveniles de tipo maníaco, en su forma aguda y/o profiláctica.
También se lo ha usado en el tratamiento y la profilaxis de la depresión mayor (unipolar y bipolar), en los trastornos esquizoafectivos y en los trastornos de conducta con agresividad.
Consideraciones farmacodinámicas y farmacocinéticas
El carbonato de litio se absorbe rápidamente por vía oral, y los picos plasmáticos se alcanzan entre la primera y tercera hora después de su ingestión. No se une a proteínas plasmáticas y se excreta enteramente por el riñón, sin metabolización. Diversos estudios farmacocinéticos demuestran que el clearance renal es mayor en niños que en adultos, por lo que la vida media del litio es más corta, y se requieren dosis más altas para obtener niveles plasmáticos terapéuticos (ver cap. 7, 7-2).
En los niños la vida media es de aproximadamente 10-18 hs. y tarda 5 a 7 días en alcanzar el estado de equilibrio. Las litemias deberán realizarse al principio en forma semanal (por lo menos, las cuatro primeras semanas), siempre 12 horas después de haber tomado la última dosis.
Cuando los niveles se mantienen constantes, es suficiente con litemias mensuales. Se están investigando métodos para correlacionar la concentración en la saliva para evitar las extracciones sanguíneas repetidas en niños pequeños.
Dosificación
Antes de iniciar el tratamiento con litio, es necesario evaluar la función tiroidea, (solicitando T3, T4, TSH), la función renal (clearance de creatinina), hemograma, ionograma, que deberán repetirse cada 6 meses.
Dado que existen muchas variaciones interindividuales, algunos autores recomiendan la utilización de parámetros farmacocinéticos para mayor seguridad, administrando una dosis única de 600 mg y un dosaje de control a las 24 horas. Esto permite predecir las dosis requeridas para alcanzar un nivel plasmático eficaz, entre 0,6 y 1,2 mEq/ 1.
La dosis es de 10-30 mg/kg, ajustada según niveles séricos. Siempre se deberá comenzar con dosis bajas, entre 150 y 300 mg/día. Es conveniente administrar el litio en tres tomas diarias, con las comidas, para reducir los efectos gastrointestinales, como son las náuseas y los vómitos.
Entre las precauciones a tener en cuenta, se debe advertir que no se deben administrar simultáneamente medicamentos antiinflamatorios no esteroideos, que algunas adolescentes utilizan durante las menstruaciones, pues pueden producir toxicidad al interferir en la excreción renal del litio, por aumento de la reabsorción tubular, con el consiguiente aumento de los niveles plasmáticos.
A los niños y adolescentes que toman litio se les debe autorizar, por razones médicas, que tomen líquidos a voluntad y que puedan ir al baño durante los horarios de clase todas las veces que lo necesiten, debido a la poliuria y polidipsia que puedan presentar.
El carbonato de litio se deposita en los huesos, pero se ignora si esto tiene algún impacto significativo en niños con crecimiento óseo, pues no se han informado interferencias en el crecimiento. En algunos casos se ha informado hipocalciuria por incremento en la reabsorción renal del calcio. El litio puede producir hiperparatiroidismo con hipercalcemia e hipofosfatemia, por lo que conviene determinar el nivel basal de calcio en sangre. Frente a resultados anormales se deberán determinar también los niveles de hormona paratiroidea.
Con respecto al ejercicio intenso y sudoración profusa (también por fiebre, sauna, o excesivo calor) se deberá evaluar la litemia, pues puede ocurrir deshidratación con pérdida de agua y sal, con el consiguiente aumento de los niveles de litio y riesgo de toxicidad. También se han descrito lo contrario, en atletas, a los que se les administró litio, luego de correr 20 km, presentaron litemias 20 % más bajas que previo a la carrera. Los autores concluyeron que en aquellas condiciones en que se alteran significativamente los electrolitos y el agua corporal se deberá monitorear la litemia.
También debe tenerse en cuenta que, a esta edad, son muy comunes los trastornos gastrointestinales, con vómitos y diarreas, y los procesos febriles, que pueden producir deshidratación, por lo que se debe tener en cuenta el peligro de sobredosificación. Deberá advertirse a los padres que suspendan la medicación en estos casos.
El litio ha sido asociado a la exacerbación del acné, tema preocupante para los adolescentes. A pesar de algunos informes contradictorios, no está comprobado que los niveles plasmáticos del litio aumenten por el agregado de tetraciclinas (frecuentemente utilizadas para el tratamiento del acné), por lo que ambos fármacos pueden asociarse
Indicaciones
– Trastorno bipolar 1 (manía y depresión)
– Trastorno bipolar 11 (hipomanía y depresión)
– Depresión mayor resistente
– Impulsividad, agresividad, conductas explosivas
– Trastornos esquizoafectivos
– Esquizofrenia resistente
– Niños con alteraciones inespecíficas de la conducta (hijos de padres con trastorno bipolar con buena respuesta al litio)
5) Ansiolíticos
La ansiedad se encuentra presente en una gran variedad de trastornos: ansiedad de separación, ataques de pánico, fobia social, agorafobia, trastorno obsesivo-compulsivo, etc.
Existe poca información sobre la eficacia y seguridad de los ansiolíticos en la población pediátrica y en general se utilizan los mismos criterios que en los adultos. Dentro del grupo de agentes ansiolíticos podemos encontrar las benzodiazepinas (BZD), los antihistamínicos (AH) y los derivados de las azapironas, como la buspirona. Como presentan un buen margen de seguridad y mínimas interacciones con otras drogas se los utilizan en trastornos con agitación e insomnio.
Benzodiazepinas
Las BZD deben ser utilizadas con mucha cautela en esta población por sus efectos sobre los procesos cognitivos y su potencial adictivo.
Consideraciones farmacodinámicas y farmacocinéticas
El recién nacido posee un hígado inmaduro y su capacidad para hidroxilar, demetilar y de conjugación glucurónida es muy limitada antes de los 5 meses. Durante la infancia y la pubertad, por el contrario, la actividad enzimática es mayor, por lo que a veces se requieren administraciones más frecuentes.
Las BZD, en los niños, alcanzan su pico plasmático 15 a 30 minutos luego de su administración y, por ser lipófilas, llegan de forma rápida al cerebro. Muchas BZD tienen metabolitos activos, lo que prolonga la duración de su acción.
La clasificación de las BZD clínicamente más útil es la que contempla dos dimensiones, por la potencia en la saturación del receptor gabaérgico (alta y baja) y por la vida media, de su duración de acción (prolongada, intermedia, corta y ultracorta) (ver cap. 4, 4-10).
La vida media contempla los parámetros farmacocinéticos, pues indica la duración de su acción, sus efectos adversos y los riesgos del fenómeno de abstinencia.
Las BZD de acción prolongada pueden ser útiles cuando también existe ansiedad diurna, junto con el trastorno del sueño. En cambio, si se quiere evitar la sedación diurna, es conveniente utilizar las BZD de vida media más corta o ultracorta (más efectivas en el insomnio de conciliación). No suelen ser útiles durante el día, pues por su vida media corta son necesarias dosis más frecuentes.
Las BZD de alta potencia, alprazolam y clonazepam, son las más utilizadas para los trastornos de ansiedad en adultos. Sin embargo, se han descrito en adultos, pero no en niños, fenómenos de abuso y de ansiedad rebote (fenómenos interdosis) con el alprazolam, tal vez por su corta vida media y la desaparición del efecto ansiolítico. También se deberá disminuir muy lentamente la dosis, para evitar estos fenómenos.
En los adolescentes debe tenerse cuidado con el uso concomitante del alcohol, por la potenciación de sus efectos sobre el sistema nervioso central y la disminución de la capacidad de alerta y reflejos. Asimismo se deberá advertir sobre los riesgos de conducir vehículos o manejar máquinas complejas.
Otro efecto adverso que ha de tenerse en cuenta es la desinhibición de la conducta. Esta reacción paradojal se caracteriza por excitación aguda, irritabilidad, ansiedad intensa, alucinaciones, agresividad, reacciones de rabia, insomnio, euforia e incoordinación. Dado que muchos trastornos infantiles se caracterizan por presentarla, se corre el riesgo de empeorar el cuadro clínico.
Dosificación
El tratamiento con BZD deberá iniciarse con una única dosis diaria e ir incrementando lentamente cada 3 a 4 días, hasta lograr la mínima dosis de mantenimiento. Luego, es conveniente esperar una semana para evaluar los efectos ansiolíticos y adversos.
Los incrementos posteriores se harán también semanalmente. La medicación para los trastornos de sueño se deberá mantener durante períodos cortos (1 a 2 meses), y para los trastornos por ansiedad, durante 4 a 6 meses.
Cuando se deban suspender las BZD, las dosis se disminuirán muy lentamente (25 % cada semana).
Indicaciones
Trastorno por angustia de separación, por ansiedad generalizada
Agorafobia, fobia social, ataques de pánico
Trastorno obsesivo-compulsivo
Trastornos del sueño
Insomnio
Terrores nocturnos, pesadillas
Trastorno por estrés post-traumático
Episodios psicóticos agudos
Síndrome de Tourette
Antihistamínicos
Los antihistamínicos se prescriben de forma habitual a niños pequeños con insomnio, ansiedad nocturna y a los que se despiertan por la noche, ya que tienen efectos sedativos.
No se conoce bien el mecanismo de acción preciso de su efecto sedativo, pero podría deberse a sus propiedades anticolinérgicas.
Los antihistamínicos más populares son la hidroxicina, la difenhidramina y han sido utilizados por más de 45 años, por su alto margen de seguridad.
La difenhidramina tiene una vida media corta (4 a 6 horas) y no prolonga la duración total del sueño. Los demás antihistamínicos tienen la desventaja de que su efecto sedativo se prolonga también durante el día.
Otra desventaja de estos fármacos es que suelen desarrollar tolerancia para el efecto sedativo, por lo que sólo serían útiles durante períodos breves o utilizados de forma intermitente.
La dosis habitual administrada como hipnótico por la noche es de 1 mg/ kg para la difenhidramina, en una sola toma nocturna. Los niños toleran dosis más altas que los adultos, y como ansiolítico se prescribe en dosis de 1 a 5 mg/kg/día, repartidas en tres o cuatro tomas, 1 o 2 cucharaditas de té 3-4 veces por día. Cada cucharadita de té equivale a 5 ml.
La dosis habitual de hidroxicina es de 2-2,5 mg/kg/día; la dosis máxima diaria es de 50 mg/d para niños menores de 6 años y hasta 100 mg/d en mayores de 6 años, repartida en tres o cuatro tomas. Los efectos adversos incluyen sedación, que puede interferir en el aprendizaje, y en caso de sobredosis, delirio, alucinaciones, excitación, convulsiones y muerte. Sus efectos anticolinérgicos también pueden empeorar el asma. Debe evitarse en adolescentes, por el riesgo potencial del abuso (efecto delirante).
Buspirona
Dentro de los ansiolíticos atípicos se encuentra la buspirona. Hay muy pocos estudios realizados en niños y adolescentes, por lo que las dosis e indicaciones de este fármaco no están bien establecidas. Parecería no tener los efectos adversos de las BZD, pero sus efectos terapéuticos suelen manifestarse a las 3-4 semanas. No debe asociarse al tratamiento con lMAO, porque se han observado episodios de hipertensión arterial.
Extrapolando su uso a los adultos, podría ser de utilidad en los casos de ansiedad excesiva y fobias, en dosis de 0,2 a 0,6 mg/kg, repartidas en tres tomas.
6) Anticonvulsivantes
Los anticonvulsivantes están indicados en los trastornos convulsivos; fuera de éstos no existen por el momento indicaciones claras de su uso, a pesar de lo cual son ampliamente utilizados en la práctica clínica, para el tratamiento de diversos trastornos psiquiátricos de niños y adolescentes. Los más utilizados son la carbamazepina, el ácido valproico y los valproatos (cuadro 15).
Son muy eficaces en el tratamiento de las conductas agresivas o impulsivas, siendo a veces posible disminuir o suspender los antipsicóticos. Su efecto antiagresivo podría deberse, como en el caso del litio, a su capacidad de aumentar la serotonina.
Los anticonvulsivantes han demostrado su utilidad en los adultos en el tratamiento del trastorno bipolar (ciclizadores rápidos) y como alternativa al tratamiento con carbonato de litio. Actualmente se realizan estudios para demostrar su efectividad, en niños y adolescentes, en indicaciones similares a las de los adultos (ver cap. 7, 7-13).
Consideraciones farmacodinámicas y farmacocinéticas
La carbamazepina tiene una farmacocinética lineal, o sea que los incrementos en las dosificaciones aumentan los niveles plasmáticos. Pero, como produce autoinducción enzimática, luego de las primeras 6 semanas de tratamiento, su vida media se acorta y los niveles plasmáticos disminuyen, por lo que a veces se necesitan ajustes de dosis. Su vida media es de 13 a 17 hs..
La inducción enzimática afecta el clearance de otros fármacos que se administren simultáneamente con la carbamazepina (neurolépticos, anticonceptivos, ácido valproico, clonazepam), requiriéndose incrementos en los dosajes.
El nivel plasmático para los trastornos convulsivos en adultos es de 4-12 ug/ ml, pero existen amplias variaciones individuales y no se conocen los rangos para los trastornos psiquiátricos.
La dosis habitual es de 10 a 20 mg/kg/día, repartidos en 2-3 tomas diarias. Se recomienda comenzar con dosis bajas, 100 mg/día repartidos en dos tomas, e ir incrementando de a 100 mg por semana para minimizar los efectos adversos. Se utilizan entre 200 y 600 mg/día en niños prepúberes. En los adolescentes la dosis inicial es de 200 mg repartidos en dos tomas incrementando lentamente hasta una dosis máxima de 1200 mg.
Su efecto terapéutico aparece entre los primeros días a las dos semanas. A corto plazo puede producir somnolencia, mareos, visión borrosa, pero en general los pacientes desarrollan tolerancia a estos efectos, que además pueden evitarse cuando las dosis se incrementan lentamente. Los rash cutáneos y urticaria, constituyen el efecto adverso más común en los niños (10-15 %) y el motivo de la suspensión del fármaco.
Otros efectos adversos menos frecuentes pero graves son la hepatotoxicidad y las discrasias sanguíneas, anemia aplástica, agranulocitosis, leucopenia, trombocitopenia. Se calcula que el riesgo de desarrollar discrasias sanguíneas es muy bajo: en la población general no tratada, la agranulocitosis ocurre en 6 por millón y la anemia aplástica en 2 por millón, que se eleva 5 a 8 veces con carbamazepina (anemia aplástica: 1 en 125.000 pacientes y neutropenia en el 2-3 % de los pacientes).
Se informaron seis casos (varones entre 10 y 16 años) que estaban participando de un protocolo para evaluar el tratamiento con carbamazepina en niños y adolescentes con trastornos de conducta y agresividad, que presentaron reacciones adversas neurológicas y conductuales (severo cuadro maníaco, hipomanía, incremento de la irritabilidad, impulsividad, agresividad y empeoramiento de la conducta). Se postula que los síntomas podrían corresponder a una manía o hipomanía que no había sido diagnosticada.
La carbamazepina puede producir síndrome inadecuado de secreción de hormona antidiurética (SIHA), que se manifiesta por retención de agua e hiponatremia asociados a letargia, debilidad, cefalea, náusea y edemas.
Un nuevo compuesto, la oxcarbazepina, no presentaría los efectos alérgicos y de autoinducción enzimática.
El ácido valproico y los valproatos, tienen una vida media de 8 a 16 horas en adultos y de 5 a 14 hs. en niños. Los niveles terapéuticos para los trastornos convulsivos son de 50-100 ug/ml. No se conocen los rangos de dosificación, ni niveles plasmáticos para uso psiquiátrico en niños y adolescentes. La dosis inicial es de 5 a 15 mg/kg/día, que se puede incrementar hasta 60 mg/kg/día, repartidos en tres tomas. En niños menores de 2 años, con epilepsia, se han descrito hepatotoxicidad fatal, asociado a otros anticonvulsivantes.
Produce inhibición enzimática hepática, incrementando su propio nivel plasmático y de otros fármacos que utilizan la misma vía metabólica.
Antes de iniciar el tratamiento con anticonvulsivantes deben realizarse hemograma (recuento de glóbulos blancos y de plaquetas), hepatograma y electrocardiograma (que deberán repetirse cada 3-6 meses).
Indicaciones
– Epilepsia
– Neuralgia del trigémino
– Enfermedad bipolar I y 11 (con resistencia o intolerancia al carbonato de litio, cicladores rápidos)
– Conductas agresivas e impulsivas
– Trastorno límite de la personalidad
– Trastorno esquizoafectivo
– Labilidad emocional
– Trastorno explosivo intermitente
7) Otros medicamentos
Clonidina
En los últimos años ha despertado interés el uso en psicofarmacología del antihipertensivo clonidina. Actúa como un agonista alfa-2 adrenérgico. Estimula los autorreceptores presinápticos, inhibe la liberación de noradrenalina, aumenta el turn-over de dopamina y disminuye la serotonina plasmática.
Su principal efecto psicoactivo es la sedación. En algunos casos también puede producir hipotensión, sequedad de la boca, depresión y confusión, Por este motivo estaría contraindicada en pacientes con antecedentes de patología cardiovascular y con sintomatología depresiva o antecedentes familiares de depresión.
La dosis debe disminuirse lentamente para evitar la hipertensión de rebote.
Tiene una vida media corta, de alrededor de 4 a 6 horas en niños y de 8 a 12 horas en adolescentes.
Las dosis habituales son de 3 a 10 ug/kg, alcanzadas lentamente a lo largo de varias semanas (0, 125 a 0,3 mg/día). En los niños se recomienda comenzar con medio comprimido de 0,1 mg (aproximadamente 1 a 2 ug/kg), administrado de noche para evitar la sedación e ir incrementando de a medio comprimido por semana, hasta un máximo de 0,3 mg/d, repartidos en 3 a 4 tomas diarias.
La clonidina se considera un fármaco de primera elección en los trastornos de Tourette y por tics. Puede ser una buena alternativa en aquellos trastornos (con agresividad y/o conductas de autoinjuria), en los que se usaban antipsicóticos, por sus escasos efectos adversos, o en combinación con los neurolépticos, en dosis más bajas para ambos.
También puede resultar de utilidad en el TDAH, en los que los estimulantes están contraindicados (por ejemplo, por la presencia de tics). Algunas veces es necesario un período de 4 a 6 meses para obtener los máximos beneficios en los síntomas conductales.
La guanfacina (Tenex, EE.UU.) es un fármaco antihipertensivo de acción central que se ha comenzado a utilizar con las mismas indicaciones que la clonidina. Se trata de un agonista alfa-2 adrenérgico selectivo (en contraste con la clonidina, que es menos selectiva e inhibe los subtipos alfa-2a, alfa-2b y alfa-2c). La dosis inicial es de 0,5 mg en una toma nocturna, con incrementos de 0,5 mg cada 3-4 días repartidas en 3-4 tomas diarias. El rango de dosis fue de 0,75 a 3,0 mg/día (promedio 1,5 mg).
Indicaciones
Sus indicaciones se basan en su habilidad de reducir el arousal disminuyendo el firing del locus coeruleus:
– TDAH
– Síndrome de Tourette
– Síndromes de abstinencia
– Conductas agresivas de autoinjuria
– Trastornos afectivos
– Trastorno obsesivo-compulsivo
– Trastornos por ansiedad
– Disquinesia tardía
Beta-bloqueantes
El propranolol es un antagonista beta-adrenérgico no selectivo con acción periférica y central (actúa sobre los receptores beta-1 en corazón y cerebro, y sobre los receptores beta-2 en bronquios, vasos sanguíneos y aparato gastrointestinal).
El pico plasmático se obtiene entre la hora y hora y media. La vida media es corta, de 2 a 9 horas (promedio 4 horas). Gran parte se une a proteínas plasmáticas y se metaboliza totalmente antes de excretarse por orina.
Aunque el propranolol aparece como un agente promisorio en el tratamiento de conductas agresivas y violentas, se carece hasta el momento de información suficiente sobre su eficacia y seguridad en niños y adolescentes.
Los efectos adversos que pueden llegar a limitar su uso son bradicardia e hipotensión, así como aumento de la resistencia del árbol respiratorio, por lo que están contraindicados en los asmáticos y en algunos pacientes cardíacos.
Debe ser utilizado con precaución en diabéticos, pues puede incrementar la acción hipoglucemiante de la insulina y enmascarar una taquicardia que podría advertir la existencia de hipoglucemia.
Deben controlarse su administración conjuntamente con un cardiólogo y monitorearse el ECG, la presión arterial y la frecuencia cardíaca (deberá mantenerse por encima de valores de 90/60 mm Hg y de 60/minuto, respectivamente). De suspenderse, será de manera gradual, pues puede producir hipertensión de rebote (11 S).
Otros efectos adversos poco frecuentes incluyen depresión con insomnio, somnolencia, fatiga y debilidad, por lo que no debe indicarse en niños y adolescentes con síntomas depresivos. También se han observado alucinaciones, pesadillas y sueños vívidos.
Indicaciones
– Acatisia por psicofármacos (neurolépticos o IRSS)
– Temblor (inducido por litio)
– Trastornos por ansiedad con importantes componentes somáticos (ataques de pánico, agorafobia, fobia social, ansiedad generalizada, trastorno por estrés postraumático)
– Agresión y autoagresión en los trastornos de conducta y en los trastornos generalizados del desarrollo con retraso mental y TDAH
– Síndrome de Tourette
– Esquizofrenia
– Trastorno explosivo intermitente
Las dosis habituales varían entre 1 a 5 mg/kg/día. La dosis efectiva para niños y adolescentes no ha sido establecida, pero probablemente el rango de dosis es de 40 y 320 mg/día. Debe iniciarse el tratamiento con 10-20 mg dos a tres veces por día (30-60 mg/d), incrementando la dosis de 10 a 20 mg cada 37 días.
Fenfluramina
El clorhidrato defenfluramina fue una amina simpaticomimética originalmente utilizada en el tratamiento de la obesidad, que disminuye las concentraciones sanguíneas y cerebrales de la serotonina, cuya comercialización fue discontinuada, por haberse comprobado la aparición de hipertensión pulmonar en los adultos.
En el 30 a 40 % de los niños con autismo se han encontrado niveles séricos elevados de serotonina, y también se han correlacionado positivamente los niveles de serotonina con la severidad del retraso mental en niños con retraso mental idiopático. Por este motivo, han sido numerosas las investigaciones, en especial recientes, sobre la utilidad de la fenfluramina en niños autistas, en los que tienen CI superior a 40 y agitación intensa.
Naltrexona
La naltrexona es un antagonista opiáceo utilizado en la deshabituación alcohólica de los adultos. Estaría indicada, en un subgrupo de niños autistas que presentan niveles elevados de endorfinas, con retraso mental y/o con conductas autoagresivas.
Habría dos hipótesis que implican aumentos del sistema opiáceo:
1) Estos pacientes tendrían un umbral al dolor anormalmente elevado y, en consecuencia, una alta probabilidad de autoagredirse seriamente como mecanismo de autoestimulación.
2) La autoagresión podría estar reforzada, pues llevaría a un aumento en la liberación de endorfinas. Los antagonistas opiáceos disminuirían el umbral al dolor, con lo que las autoinjurias serían más dolorosas y minimizarían los efectos euforizantes de las endorfinas liberadas, anulando el refuerzo positivo de las conductas autoagresivas.
Se han utilizado dosis de 0,5 a 2,0 mg/kg/día en el tratamiento de la autoagresión, pero no existen aún estudios suficientes. Los efectos adversos más comunes fueron: dificultad en el sueño, ansiedad, nerviosismo, náuseas, dolor estomacal y cefaleas. En el 70 % se observó sedación. Está contraindicada en pacientes con abstinencia opiácea aguda, hepatitis o insuficiencia hepática, con analgésicos opiáceos y en la dependencia de opiáceos.
Algunos estudios doble-ciego, controlados con placebo, han mostrado escasa eficacia en el tratamiento de los síntomas cognitivos y sociales del autismo y estaría contraindicado en el síndrome de Rett.
Análogo de la hormona antidiurética: desmopresina
El análogo sintético de la hormona antidiurética desmopresina (DDAVP) (Desmopresin), posee una potencia antidiurética mayor que la hormona, casi sin actividad sobre el músculo liso.
Se está utilizando en la enuresis funciona¡. Se presenta como solución intranasal en spray con dosificadores para su aplicación (rhinyles) y en comprimidos de 0.2 mg. La dosis diaria es de 0.1 a 0.2 ml (20-40 ug/kg), en una toma nocturna. Tiene un efecto de la supresión de la producción de orina durante 7-10 hs. sin el efecto presor de la hormona antidiurética pura. Los efectos adversos son mínimos, siendo los más comunes náuseas, cefaleas, hipotensión y calambres musculares. Ha sido demostrada su utilidad y seguridad en el largo plazo.
4) Consideraciones farmacodinámicas y farmacocinéticas específicas
a) Absorción
b) Distribución
c) Metabolismo
d) Excreción
Se clasifica a las etapas infanto juveniles en cuatro períodos, según sus características fisiológicas, y los mecanismos que intervienen en la biotransformación de los fármacos.
1 ) Período neonatal: que incluye los prematuros y recién nacidos a término, hasta el primer mes,
2) Período infantil: de 1 a 12 meses,
3) Período de la niñez: de 1 a 12 años, y
4) Período de la adolescencia: de 13 a 18 años.
La farmacocinética de los psicofármacos cambia a medida que aumenta la edad, de acuerdo con el desarrollo de las funciones fisiológicas.
Algunos mecanismos metabólicos todavía no están desarrollados en el prematuro y el recién nacido. Por lo tanto, pueden producirse acumulaciones tóxicas de los fármacos si la conversión de las dosis se efectúa teniendo en cuenta solamente el peso corporal y las dosis utilizadas en los adultos.
La respuesta a los fármacos durante las primeras semanas de vida varía ostensiblemente, y recién a partir del primer año comienza a asemejarse a la de los adultos.
a) Absorción
Los principales factores que influyen en la absorción gastrointestinal son la difusión pH-dependiente y el tiempo de vaciamiento estomacal. Luego el fármaco entra a la circulación portal y llega al hígado donde se produce el metabolismo de primer paso.
No existe mucha información acerca de cómo influye la edad en la absorción de los psicofármacos, aunque existen algunas consideraciones teóricas. Se sabe por ejemplo que en los niños el contenido estomacal tiende a ser menos ácido que en los adultos, por lo que las drogas débilmente ácidas están más ionizadas, y por consiguiente su absorción es más lenta ya que se absorbe la fracción no ionizada. Este proceso podría afectar teóricamente a los anticonvulsivantes, antidepresivos y anfetaminas.
Los niños tienen menor flora intestinal y menos diversificada. Como las fenotiazinas se pueden absorber y metabolizar en la pared intestinal, esto podría explicar por qué algunos niños son resistentes a estos fármacos o requieren mayores dosis orales.
A pesar de estas consideraciones teóricas, no existen evidencias clínicas de que la absorción se encuentre reducida en niños. Por el contrario, algunos reportes anecdóticos sugieren que la absorción puede ser más rápida en niños que en adultos, lo que no sería deseable, ya que si bien esto no afecta la concentración plasmática estacionaria final, la toxicidad de algunas drogas puede estar en función de un alto pico plasmático. Un alto pico plasmático, debido a una rápida absorción podría explicar la cardiotoxicidad de algunos fármacos
En líneas generales, se puede concluir que en la práctica no existen diferencias notables en la absorción intestinal de niños y adultos.
Las enfermedades del tracto gastrointestinal, típicas de la infancia, pueden alterar la absorción de fármacos administrados por vía oral. La absorción por vía intramuscular suele ser errática y estar disminuida, al contrario de la vía subcutánea, que suele ser más rápida y extensa que en los adultos.
b) Distribución
Luego de su absorción, los fármacos se distribuyen en el espacio intravascular y varios espacios extravasculares.
Los dos factores más importantes que afectan este proceso y que se modifican con la edad, son los depósitos grasos y la proporción entre el agua corporal total y el agua extracelular.
La relación entre la cantidad de droga absorbida (D), la concentración plasmática (Cp) y el volumen de distribución (Vd), puede resumirse en la siguiente ecuación: Cp=D/Vd. Se desprende que a mayor Vd, menor Cp.
Hasta el primer año, la composición corporal difiere sustancialmente de la del adulto. La proporción de agua corporal (total y extracelular) es mayor en el recién nacido; por ej. representa el 85 % del peso corporal en un prematuro, alcanza el 70 % en un nacido a término y desciende progresivamente hasta alcanzar valores similares a los del adulto a los 12 meses (aproximadamente el 60 % del peso total). En forma similar, también disminuye la proporción de agua extracelular, de 40-50 % del peso corporal en un recién nacido, hasta 1520 % a la edad de 10-15 años. Por consiguiente, las drogas que se distribuyen primariamente en el agua corporal, como el litio, presentan una menor concentración plasmática en la población pediátrica que en los adultos.
También varía el tejido subcutáneo, que es más voluminoso hasta los 9 meses y desciende progresivamente hasta los 6 años, para aumentar de nuevo en la adolescencia. Las drogas altamente lipofílicas, como los neurolépticos y los antidepresivos, son afectadas por la cantidad de tejido adiposo. Pero al contrario de lo que podría suponerse (a menor tejido adiposo, mayor concentración plasmática de drogas lipofílicas), estas drogas pueden presentar menores concentraciones plasmáticas de las esperadas, debido a otros mecanismos, como el incremento en el metabolismo hepático.
La biodisponibilidad de los fármacos depende de su unión con las proteínas plasmáticas, siendo la porción no unida a proteínas la que puede atravesar la barrera hematoencefálica. Aunque la unión a proteínas se encuentra disminuida en niños pequeños, esto no parece tener significación clínica en niños mayores y en adolescentes, siendo comparable a la de los adultos. Sin embargo, algunos procesos febriles, o la administración de antibióticos (muy comunes en la infancia), pueden incrementar la cantidad de proteínas circulantes, siendo conveniente monitorear cuidadosamente los niveles plasmáticos y los efectos adversos durante esos períodos.
c) Metabolismo
La capacidad de los recién nacidos para metabolizar los fármacos es baja, aunque está en función de la integridad de los sistemas enzimáticos específicos para cada vía metabólica. Durante el primer año de vida se desarrollan, de manera gradual, los diferentes sistemas enzimáticos; el período perinatal es el más sensible a los efectos deletéreos de fármacos y compuestos (por ejemplo, bilirrubina) que se eliminan por biotransformación hepática.
La mayoría de los psicofármacos sufren una extensa biotransformación hepática; en la fase 1, las reacciones metabólicas de hidroxilación, oxidación e hidrólisis los convierten en metabolitos menos activos y menos tóxicos. En la fase 2, estos metabolitos son conjugados con ácido glucurónico y excretados por orina. Algunos fármacos como el lorazepam pasan directamente a la fase 2 lo que puede realizarse en cualquier órgano y no depende de la suficiencia hepática.
Algunas drogas, como el fenobarbital, la carbamazepina, la fenitoína, el alcohol, y el cigarrillo son inductores de las enzimas microsomales hepáticas, y por lo tanto, reducen la concentración plasmática de otras drogas que utilizan esa vía metabólica. Por el contrario, la fluoxetina, la paroxetina, fluvoxamina, cimetidina, el ácido valproico pueden inhibir las enzimas hepáticas, resultando en un nivel plasmático más elevado y potencialmente tóxico de otras drogas suministradas simultáneamente.
En niños se requieren dosis relativamente mayores que en adultos para la mayoría de los psicofármacos, lo que se explica por un incremento de la capacidad de metabolización hepática. En general, las vías metabólicas funcionan a bajo nivel en el período perinatal, maduran alrededor de los 6 meses, aumentan entre 1-5 años y declinan gradualmente a los valores adultos alrededor de los 15 años. El tamaño relativo del hígado en relación al peso corporal también es mayor en los niños que en los adultos.
d) Excreción
El riñón es el principal órgano para la excreción de drogas. Tres mecanismos están implicados: la filtración glomerular, la secreción tubular y la reabsorción. La función renal de los recién nacidos está disminuida, y alcanza valores semejantes a los del adulto sólo a los 6-12 meses de vida y no tendrían tanta significación los cambios producidos por la edad, aunque algunos autores consideran que a efectos prácticos el clearance renal de algunos fármacos como el litio estaría ligeramente aumentado. Los psicofármacos, que se excretan en proporciones elevadas por vía renal, deben administrarse con suma precaución en niños de meses.
En general, y a efectos prácticos, se presume que a partir del primer año de vida los niños y los adolescentes requieren dosis más altas de psicofármacos por unidad de peso corporal que los adultos, para alcanzar niveles plasmáticos y eficacia terapéutica similares. Ello se explica fundamentalmente, como dijimos, por el mayor metabolismo hepático y el aumento de la filtración renal.
Estas características disminuyen gradualmente durante la infancia. Puede ocurrir un cambio abrupto en la pubertad, y llegar a los niveles del adulto en la adolescencia media tardía. Por esto se debe estar muy alerta a los posibles cambios farmacocinéticos durante la pubertad, y ajustar las dosis. Si en un niño que entra en la adolescencia aparece un cambio en la respuesta terapéutica a un fármaco, es conveniente solicitar el dosaje plasmático.
Existen, además, cambios farmacodinámicos (mecanismo fármaco-efector) producidos por la maduración de las vías neurológicas y sus funciones, y cambios farmacocinéticos causados por cambios madurativos en la distribución, el metabolismo y la excreción.
Hay algunas evidencias de que, en la niñez, los sistemas catecolaminérgicos (noradrenalina, adrenalina y dopamina) no estarían desarrollados de manera plena, desde el punto de vista anatómico y funcional.
La prevalencia relativamente alta del TDAH en niños y la mejoría espontánea, en algunos casos, con el paso del tiempo podrían reflejar cambios madurativos en la función catecolaminérgica.
El hecho de que los niños respondan a la medicación estimulante sin excitación o euforia, respecto de lo anímico, con el agregado de que la manía es rara en esta edad, podría explicarse por la inmadurez de los sistemas catecolaminérgicos y considerado como el resultado de factores farmacodinámicos relacionados con el desarrollo.
Existe una clara relación entre la concentración plasmática y la respuesta clínica a la imipramina en sujetos prepúberes y en adultos con depresión endógena, pero no en adolescentes. Ello se debería al incremento de los niveles de hormonas sexuales, que tendría un efecto negativo sobre la acción antidepresiva de la imipramina. Los IMAO podrían ser particularmente útiles en adolescentes deprimidos que no respondiesen satisfactoriamente a los tricíclicos.
Algunos autores han encontrado que los niños tendrían una mayor densidad de receptores dopaminérgicos DI y D2 que los adultos, lo que explicaría por qué son sensibles a menores dosis de neurolépticos (a pesar de que por su farmacocinética, la vida media y la concentración plasmática están disminuidas).
Finalmente, existen variaciones farmacocinéticas no sólo entre grupos etarios sino también entre individuos de la misma edad. Por razones genéticas no del todo explicadas, algunas personas pueden ser muy sensibles a una medicación dada (metabolizadores lentos, 5 a 10 % de la población), mientras que otras pueden ser relativamente resistentes o no respondedores (metabolizadores rápidos).